La Administración de Alimentos y Medicamentos de EE.UU. (FDA, por sus siglas en inglés) aprobó este lunes Apretude, el uso del primer medicamento inyectable para prevenir la infección por el virus de inmunodeficiencia humana (VIH).
«Tanto en los adultos y adolescentes en riesgo que hayan dado negativo justo antes de iniciar el tratamiento y cuya masa corporal supere los 35 kilos»; reza el comunicado de la FDA.
Today we approved the first injectable treatment for use in at-risk adults and adolescents weighing at least 35 kilograms (77 pounds) for pre-exposure prevention to reduce the risk of sexually acquired HIV. https://t.co/TBU7pU6gOo pic.twitter.com/mnGkYt4xoM
— U.S. FDA (@US_FDA) December 20, 2021
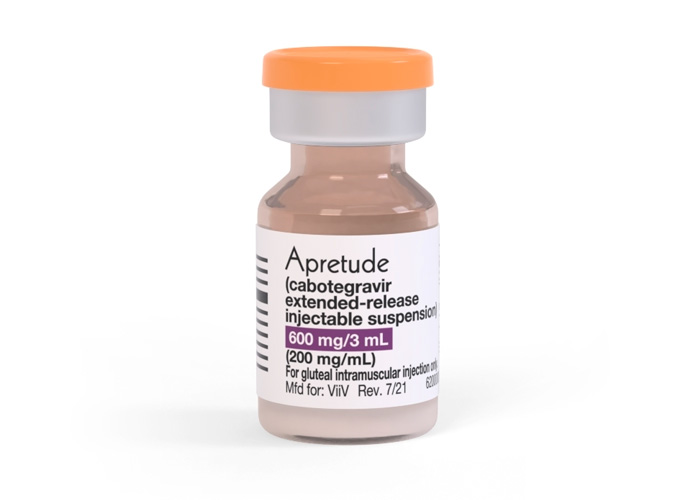
El fármaco, denominado Apretude, que se debe administrar cada 60 días después de que el paciente reciba sus dos primeras dosis con un mes de diferencia; es una alternativa al medicamento de profilaxis previa a la exposición (o simplemente, PrEP) existente, Truvada, una pastilla que se toma a diario para prevenir el VIH.
Apretude: Primer medicamento inyectable para prevenir el VIH
Aunque las medicinas orales han demostrado ser bastante efectivas, estas requieren altos niveles de adherencia, mientras que ciertas personas y grupos enteros tienden a descuidar el uso diario del fármaco.
Así mismo, se espera que el uso de un PrEP inyectable con un efecto prolongado aumente la adherencia en los grupos en riesgo.
La seguridad y la eficacia de Apretude se evaluaron mediante dos ensayos. Uno de ellos, que incluyó a 4.566 hombres cisgénero y mujeres transgénero que tienen relaciones sexuales con hombres; reveló que los participantes que recibieron el fármaco inyectable tenían un 69 % menos de probabilidades de infectarse con VIH que aquellos que tomaban Truvada.
El segundo ensayo, que reunió a 3.224 mujeres cisgénero; descubrió que las participantes tenían un 90 % menos de posibilidades de contraer VIH que aquellas que tomaban la pastilla.
Efectos secundarios
No obstante, en ambos ensayos, los efectos secundarios se produjeron con mayor frecuencia en los participantes que recibieron Apretude; aparte de las reacciones cutáneas locales, presentaron dolor de cabeza, fiebre, fatiga, dolor de espalda, dolores musculares e inflamación de la piel.
La FDA avaló la inyección, aunque dejó constancia de una serie de precauciones relacionadas con reacciones de hipersensibilidad, hepatotoxicidad (es decir, daño hepático) y trastornos depresivos.
Otros dos estudios realizados en 13 países por la empresa farmacéutica británica GlaxoSmithKline (GSK), independientemente de la FDA; también confirmaron la eficacia superior de Apretude frente a Truvada.